Des ovocytes humains entièrement cultivés « in vitro »
Des ovocytes humains entièrement cultivés « in vitro »
Par Paul Benkimoun
L’obtention de ces cellules sexuelles pourrait permettre de préserver les chances de fertilité de femmes atteintes d’un cancer. Mais chez la souris, les descendants issus de cette technique souffrent fréquemment d’anomalies.
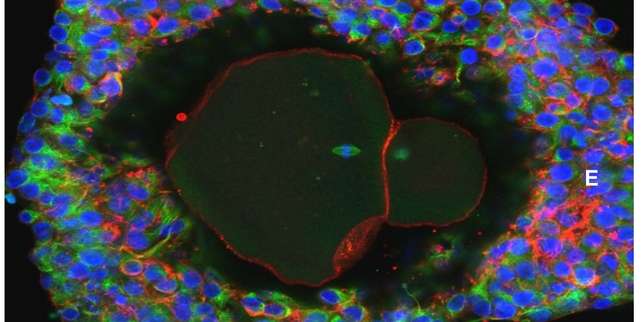
Ovocyte humain au stade mature prêt à être fécondé après développement in vitro. / Pr David Albertini
Cela avait été fait pour la souris, mais pas pour l’espèce humaine. Une équipe de chercheurs d’Edimbourg, dirigée par Evelyn Telfer, est parvenue à développer in vitro des ovocytes humains jusqu’au stade mature, où ils sont fécondables par un spermatozoïde, à partir des follicules primordiaux que contient le tissu ovarien. Jusqu’ici, cela n’avait été réalisé qu’à partir de follicules plus tardifs ayant déjà accompli une partie de ce développement. Publié dans le numéro de février de la revue Molecular Human Reproduction, leur travail ouvre des perspectives pour mieux traiter certains problèmes de fertilité, notamment chez les femmes atteintes d’un cancer.
La mise en route d’un traitement contre un cancer solide ou une hémopathie maligne, que ce soit une chimiothérapie antitumorale, une radiothérapie ou une chirurgie du pelvis, risque d’entraîner des troubles potentiellement définitifs du fonctionnement des organes génitaux, ovaires ou testicules, avec à la clé un risque d’infertilité. Afin de préserver la fertilité et pour éviter la toxicité pour les ovaires, il est possible de prélever et de conserver soit des ovocytes ou des embryons, soit de conserver du tissu ovarien.
Eviter un recours à la greffe
Cette dernière option permet de restaurer une fonction ovarienne complète par une greffe ultérieure du tissu prélevé. Elle présente toutefois le risque, dans le cas d’un cancer ovarien, que soient réimplantées des cellules malignes présentes dans le greffon. « Il faut se représenter le désespoir de patientes dont le tissu ovarien a été congelé sans qu’on soit sûrs de pouvoir le réimplanter sans risque de métastases », souligne la professeure Nelly Achour-Frydman, responsable de la biologie de la reproduction au Centre d’étude et de conservation des œufs et du sperme humains de l’hôpital Antoine-Béclère (Clamart, AP-HP). D’où l’idée de chercher une technique de développement de follicules matures à partir de follicules primordiaux, ce qui dispenserait du recours à la greffe de tissu ovarien. Jusqu’ici, la réalisation d’un tel cycle complet in vitro n’a été menée à bien qu’à partir d’ovaires de souris qui ont permis la naissance de souriceaux.
Mary McLaughlin (Institute of Cell Biology, université d’Edimbourg), première auteure, et ses collègues ont travaillé sur un nombre limité d’échantillons de tissu ovarien, donnés par dix femmes ayant accordé leur consentement à cet acte au cours d’une césarienne. « Il s’agit donc de tissu normal et même performant puisque prélevé chez des femmes enceintes », remarque le professeur Michael Grynberg, chef du service de médecine de la reproduction à l’hôpital Antoine-Béclère.
« Peu de recul sur la descendance »
Les différentes étapes, notamment celle de la division cellulaire qui fait passer l’ovocyte de deux jeux de chromosomes à un seul, ont été accomplies in vitro en trois semaines quand, physiologiquement, le processus se déroule en huit à onze mois chez la femme. Ayant perfectionné sa technique de culture, l’équipe écossaise, qui travaille de longue date sur ces sujets, a ainsi « obtenu des ovocytes qui ont réussi à grossir et à parvenir à un stade de maturation correcte, même si certains produits des divisions cellulaires sont d’une taille trop grande, au détriment de l’ovocyte. Celui-ci est normalement très gros, car il doit assurer seul les besoins de l’embryon pendant ses trois premiers jours », résume la professeure Achour-Frydman, qui estime qu’il s’agit là d’une « belle avancée en biologie ».
A ce stade, rien ne peut, cependant, être déduit sur la compétence pour la reproduction qu’auraient ces ovocytes obtenus in vitro : jusqu’à quel point les chercheurs sont-ils parvenus à mimer la nature ? « Chez l’animal, il y a peu de recul sur la descendance conçue à partir d’ovocytes produits in vitro et pas beaucoup de souriceaux normaux obtenus ainsi. Cela ne marche pas très bien, sans doute parce qu’in vitro, sur un délai court, on doit forcément shunter certaines étapes. Nous n’en sommes donc qu’au tout début », tempère le professeur Grynberg.







